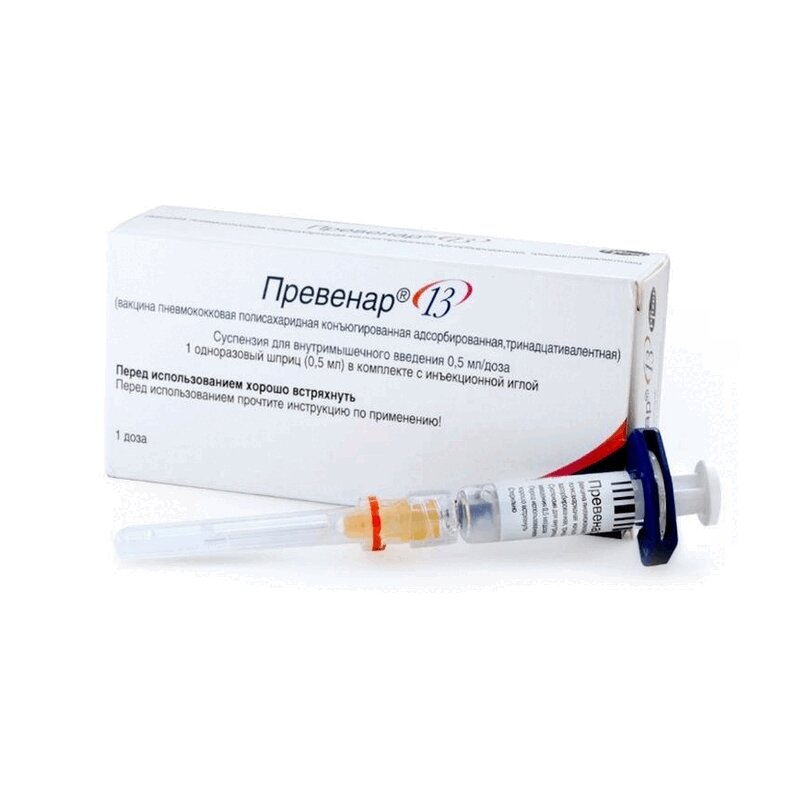
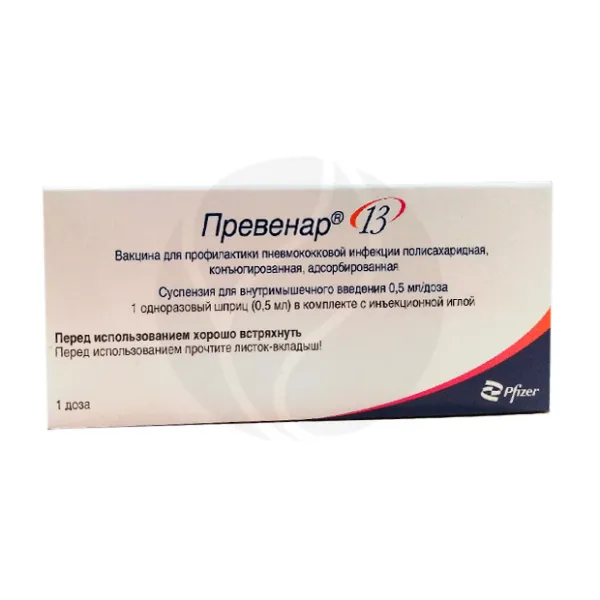
Вакцина Превенар 13 суспензия для внутримышечного введения 0,5мл

Источник изображений товара: Аптека Вита. Внешний вид товара может отличаться от изображённого
- Бренд:
- Производитель:
- Модель:
Информация носит справочный характер и не является руководством к применению. Обязательна консультация врача.
Вакцина Превенар 13 суспензия для внутримышечного введения предназначена для профилактики пневмококковой инфекции. Эта полисахаридная и конъюгированная вакцина дает защиту от 13 серотипов бактерий Streptococcus pneumoniae, вызывающих такие опасные заболевания, как менингит, пневмония, сепсис, бактериемия и отит. Превенар 13 помогает организму вырабатывать собственные антитела, укрепляя иммунитет и снижая риск развития серьёзных осложнений. Вакцина особенно важна для детей с 6 недель, а также для взрослых старше 18 лет. Благодаря адсорбированному на фосфате алюминия компоненту и содержанию CRM197, препарат обладает высокой степенью эффективности и безопасности. Вакуум производится в виде гомогенной суспензии белого цвета, которая легко вводится внутримышечно. Хранить её необходимо в холодильнике при температуре 2-8C, избегая замораживания. Вакцина прошла клинические испытания и соответствует стандартам качества.
Информация о товаре может содержать неточности, перед покупкой проверяйте информацию на сайте производителя.
Высокая эффективность защиты от 13 серотипов пневмококков, безопасность и удобство в использовании, подходит для детей и взрослых
Требует хранения в холодильнике, возможны побочные реакции как при любой вакцине, противопоказана при аллергии